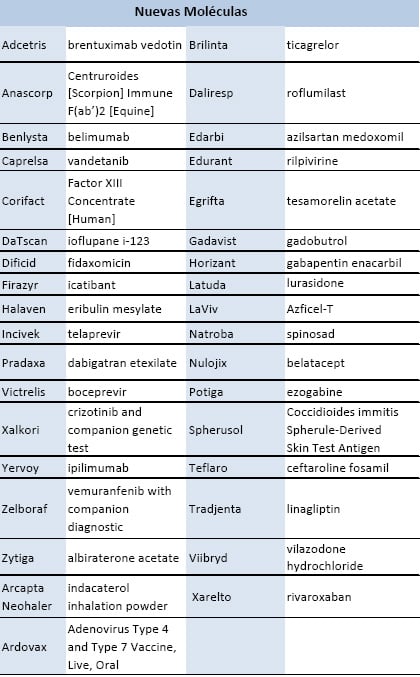
Listado de la FDA.
|
Redacción. Madrid
En los últimos 12 meses la FDA aprobó 35 nuevos medicamentos. Este es uno de los mayores números de aprobaciones en la última década, sólo superado por 2009 (37). Según la propia FDA, muchos de los fármacos son importantes avances para los pacientes, incluyendo: dos nuevos tratamientos para la hepatitis C, un medicamento para el cáncer de próstata en etapa tardía, el primer fármaco para el linfoma de Hodgkin en 30 años, y el primer fármaco para el lupus en 50 años.
Estos datos aparecen en el informe ‘Aprobación de medicamentos innovadores en 2011’. La FDA aporta detalles de cómo se han acelerado las aprobaciones, la flexibilidad en los requisitos de los ensayos clínicos y los recursos recaudados en virtud de la Ley de Medicamentos Recetados para aumentar el número de aprobaciones de medicamentos innovadores. La agencia estadounidense afirma que las aprobaciones han aumentado pese a que las normas de seguridad de medicamentos se han mantenido firmes.
El informe destaca que los tiempos de aprobación son más rápidos en los Estados Unidos en comparación con los de las agencias homólogas de todo el mundo. Veinticuatro de los 35 fármacos se aprobaron antes en Estados Unidos que en cualquier otro país (incluyendo la Unión Europea).
“Treinta y cinco aprobaciones de medicamentos importantes en un año representa un muy buen rendimiento, tanto por la industria como por la FDA, y nuestro objetivo es seguir utilizando todos los recursos posibles para conseguir nuevos tratamientos para los pacientes”, ha señalado Margaret Hamburg, comisionada de Alimentos y Medicamentos.
Entre los nuevos medicamentos aprobados, dos (uno para el melanoma y uno para el cáncer de pulmón) son avances en medicina personalizada. Cada uno fue aprobado con un test diagnóstico que ayuda a identificar los pacientes en los que el fármaco traerá mayores beneficios.
Además, casi la mitad de los medicamentos se consideraron significativos avances terapéuticos sobre los tratamientos existentes (para el ataque cardiaco, accidente cerebrovascular y el rechazo de trasplantes de riñón).
También cabe destacar que diez son para las enfermedades raras o enfermedades ‘huérfanas’, que a menudo carecen de cualquier tratamiento, debido al número pequeño de pacientes con la enfermedad, tales como tratamiento para el angioedema hereditario, y que casi la mitad (16) del total aprobado fueron evaluados bajo “revisión prioritaria”, en la que la FDA tiene una meta de seis meses para completar su revisión de seguridad y eficacia.
|